Con người đã phải trải qua nhiều đợt bùng phát virus nghiêm trọng trong 100 năm qua. Những đợt bùng phát virus này bao gồm cúm Tây Ban Nha và các dịch cúm tương tự khác, Ebola, MERS, SARS-CoV, HIV và đại dịch virus Corona gần đây—SARS-CoV-2.
Trong khoảng thời gian này, khoa học đã có những tiến bộ đáng kể trong việc giải thích nhiều khía cạnh khác nhau của sự bùng phát virus, chẳng hạn như khả năng lây nhiễm, độc lực, khả năng gây bệnh, lây truyền và xu hướng gây ra đại dịch hoặc dịch bệnh.
Các phương pháp hiện đại như xét nghiệm lây nhiễm, nuôi cấy tế bào, xét nghiệm miễn dịch, PCR, kính hiển vi điện tử và kính hiển vi huỳnh quang đã cho phép mọi người hiểu rõ hơn về quá trình nhân lên của virus, vòng đời của virus cũng như sự tương tác giữa virus và vật chủ.
Ngày nay, các nhà khoa học đã hiểu rõ hơn về chức năng và cấu trúc của bộ gen virus, hạt virus, phản ứng miễn dịch, sự tương tác giữa tế bào vật chủ và virus và mức độ biểu hiện DNA hoặc RNA. Những tiến bộ như vậy đã dẫn đến sự phát triển của thuốc và vắc-xin để điều trị nhiều loại vi-rút khác nhau.
Một trong những phương pháp mới nhất hiện có để nghiên cứu virus là kính hiển vi lực nguyên tử hay AFM. AFM là phương pháp dựa trên công nghệ Cantilever, sử dụng tip nhọn để kiểm tra các bề mặt ở độ phân giải nằm trong giới hạn nhiễu xạ quang học.
Ngoài việc chụp ảnh, AFM còn là một công cụ mạnh mẽ để thao tác nano và thăm dò cơ học nano. AFM có ưu điểm lớn là nó có thể hoạt động trên các mẫu chìm trong chất lỏng. Khía cạnh này cho phép các thí nghiệm được thực hiện trên tế bào sống ở các điều kiện sinh lý phù hợp. Các nhà khoa học đã sử dụng hình ảnh AFM để phân tích các hạt virus sống và nghiên cứu hình thái, kích thước và cách đóng gói vật liệu gen của virus.
Bên cạnh việc chụp ảnh, kỹ thuật AFM đã được sử dụng để điều khiển các virus đơn lẻ thông qua quang phổ lực để phân tích các hiện tượng tương tác ban đầu giữa virus và vật chủ. Bài viết này tóm tắt hai phương pháp dựa trên công nghệ Cantilever tương đối mới để nghiên cứu sự tương tác giữa virus và vật chủ ở cấp độ đơn bào.
Trong trường hợp đầu tiên, phân tích dựa trên thí nghiệm dùng Cantilever rỗng để gắn các hạt vi rút trên một tế bào và phản ứng của tế bào chủ sau khi bị nhiễm vi rút sau đó. Trong trường hợp thứ hai, một loại vi-rút được sử dụng để lây nhiễm các tế bào đơn lẻ được gắn vào Cantilever và tác động của việc lây nhiễm lên khối tế bào được theo dõi trong vài giờ.
Mục tiêu của nghiên cứu đầu tiên là nghiên cứu khả năng tương hợp của các hạt virus trong quá trình lây nhiễm lên tế bào. Nói một cách đơn giản, mục tiêu là xác định xem khả năng lây nhiễm của virus phụ thuộc vào số lượng hạt virus tấn công tế bào như thế nào.
Để phân tích khả năng tương hợp của việc lây nhiễm vi rút, cần phải kiểm soát chính xác thời gian lây nhiễm cũng như số lượng virion mà tế bào tiếp xúc.
Viện Vi sinh học của ETH Zurich và Phòng thí nghiệm Cảm biến sinh học và Điện tử sinh học, cả hai đều là những phòng thí nghiệm tiên phong, đã sử dụng một công cụ thao tác dựa trên Cantilever có tên là FluidFM® để gắn chính xác một số lượng hạt virus xác định vào các tế bào đơn lẻ. Công cụ này có thể được tích hợp vào AFM và sử dụng Cantilever rỗng để hút hoặc lắng đọng Virus (1). Hình 1 thể hiện sơ đồ nguyên lý của công nghệ FluidFM®.
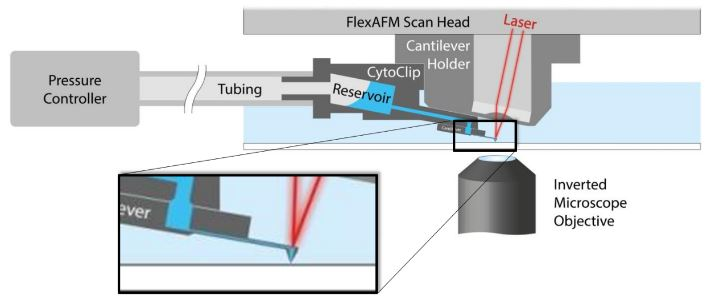
Hình 1. Sơ đồ AFM với FluidFM®. Cantilever rỗng có lỗ ở đầu tự do chứa đầy chất lỏng từ một bể chứa. Bằng cách áp dụng một chất lỏng áp suất dương hoặc âm có thể được tiết ra hoặc hút vào Cantilever để thao tác cục bộ trên mẫu. AFM xử lý việc kiểm soát lực chính xác và hệ thống hoàn chỉnh được tích hợp trên kính hiển vi quang học đảo ngược để cung cấp khả năng truy cập quang học vào mẫu. Nguồn hình ảnh: Nanosurf AG
Trong phân tích này, AFM được trang bị chức năng FluidFM® được kết hợp với kính hiển vi huỳnh quang để phân tích phản ứng của các tế bào đơn lẻ sau khi tiếp xúc với số lượng hạt vi rút khác nhau. Nhóm nghiên cứu từ ETH đã xây dựng một quy trình mới để sử dụng công nghệ FluidFM® để gửi 1 đến 12 virion vaccinia trưởng thành vào các tế bào đơn lẻ (2). Hình 2 mô tả quá trình lắng đọng virus.
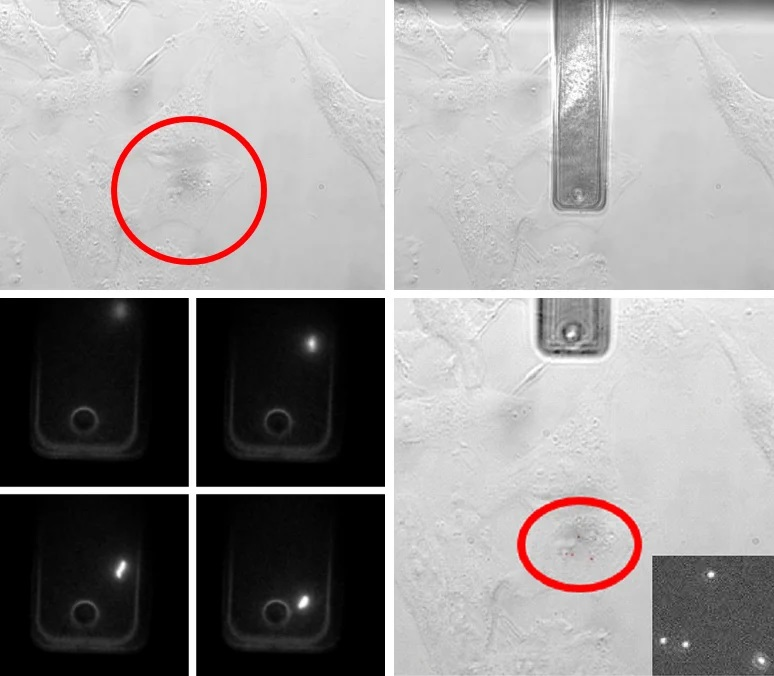
Hình 2. Bốn giai đoạn lắng đọng virus bằng Cantilever rỗng để nghiên cứu sự lây nhiễm đơn bào. I. Một tế bào được chọn bằng kính hiển vi quang học. II. Cantilever rỗng được di chuyển qua tế bào và tiếp xúc nhẹ nhàng dưới sự kiểm soát lực. III. Trong quá trình lắng đọng, các virion thoát ra khỏi công xôn được theo dõi. IV. Số lượng virion trên màng tế bào được đếm. Nguồn hình ảnh: Nanosurf AG
Để ngăn chặn sự rò rỉ của các hạt virus vào dung dịch, nếu không có thể dẫn đến lây nhiễm không kiểm soát được, Cantilever rỗng FluidFM® được đẩy nhẹ lên tế bào, tạo ra một lớp bịt kín giữa bề mặt tế bào và công cụ đúc hẫng. Do kỹ thuật AFM cung cấp khả năng kiểm soát lực dưới nanonewton nên các tế bào không bị suy giảm tại thời điểm thực hiện quá trình này.
Để theo dõi sự lắng đọng của virion và sự phát triển của nhiễm trùng, nhóm nghiên cứu đã sử dụng virus vaccinia tái tổ hợp (VACV) tích hợp protein huỳnh quang, gọi là mCherry, vào protein lõi virus A5. Thông qua protein tổng hợp này, các hạt virion được tập hợp sẽ được phát hiện bằng huỳnh quang. Điều này cũng giúp đếm số lượng hạt lắng đọng và theo dõi sự tập hợp các virion mới trong giai đoạn lây nhiễm muộn.
Hơn nữa, virus được mã hóa cho eGFP dưới sự kiểm soát của chất kích thích virus muộn hoặc sớm. Sau khi virus xâm nhập vào tế bào chủ, eGFP được biểu hiện và tạo ra một trình báo về các giai đoạn lây nhiễm khác nhau, như trong Hình 3.
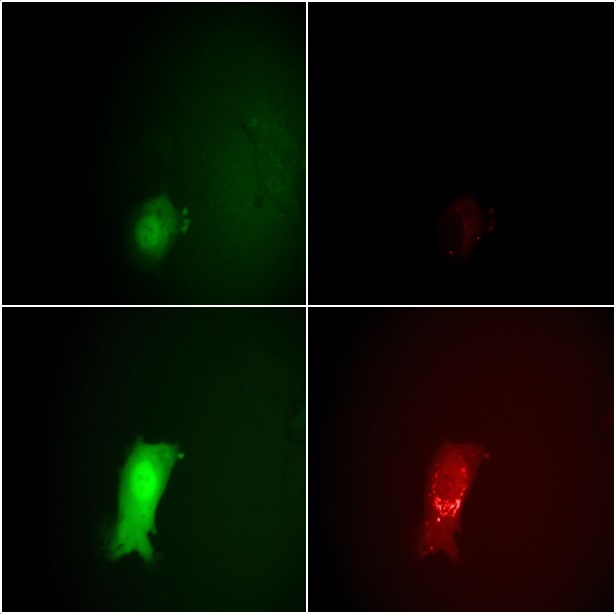
Hình 3. Theo dõi các giai đoạn của vòng đời VACV bằng kính hiển vi bằng tín hiệu huỳnh quang eGFP và mCherry. Hàng trên cùng: 7 giờ sau khi nhiễm bệnh, hàng dưới cùng: 11,5 giờ. Cường độ tín hiệu EGFP ở bên trái cho thấy rõ sự bước vào giai đoạn biểu hiện gen virus sớm và muộn. Cường độ mCherry tăng mạnh ở bên phải trong khoảng từ 7 đến 11,5 giờ cho thấy sự hình thành của các virion mới. Nguồn hình ảnh: Nanosurf AG
Kết quả nghiên cứu chứng minh tính tương hợp của việc lây nhiễm virus. Một tế bào chỉ có xác suất bị nhiễm khoảng 10% khi bị một loại virus tấn công (n = 73). Nhưng cơ hội này tăng lên khoảng 35% khi bị tấn công bởi hai hạt (n = 23) và lên 90% khi bị tấn công bởi bốn hạt virus (n = 20). Một lý do tiềm ẩn cho sự tương hợp này là cơ chế kháng virus trong tế bào chủ bị suy yếu khi nhiều virus đến cùng một lúc.
Năm 2017, các nhà khoa học từ phòng thí nghiệm Vật lý sinh học của ETH Zurich đã chứng minh cân bằng quán tính pico để định lượng khối lượng tế bào bám dính theo cách không xâm lấn và ở độ phân giải khối lượng và thời gian cao (3).
Cân bằng pico có độ phân giải thời gian tính bằng mili giây (ms) và độ nhạy khối lượng picogram. Khối lượng thu được từ tần số cộng hưởng của Cantilever và nó được tạo ra để dao động với biên độ dưới nanomet với sự trợ giúp của tia laser có cường độ khác nhau hướng vào đáy của Cantilever.
Kết quả là, tần số cộng hưởng của Cantilever giảm khi liên kết với tế bào và bất kỳ điện tích bổ sung nào trong khối tế bào sẽ thay đổi tần số cộng hưởng của Cantilever tương ứng. Hình 4 thể hiện sơ đồ nguyên lý của cân bằng pico.
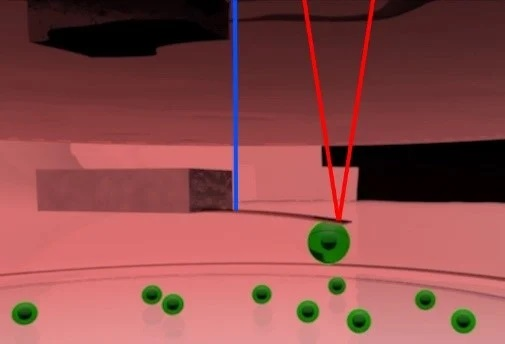
Hình 4. Sơ đồ thiết lập cân bằng pico. Cantilever được chế tạo để dao động ở biên độ khoảng 0,5nm bằng cách sử dụng tia laser được điều chỉnh cường độ ở đầu gắn của Cantilever (Màu xanh lam). Một tia laser khác tập trung vào đầu tự do của Cantilever (màu đỏ) được sử dụng để theo dõi tần số cộng hưởng của Cantilever. Khối lượng của tế bào được gắn vào Cantilever có thể được tính từ tần số cộng hưởng. Nguồn hình ảnh: Nanosurf AG
Điều kiện môi trường dưới mức tối ưu có thể dễ dàng ảnh hưởng đến sự phát triển của khối tế bào. Để tránh điều này, một hệ thống môi trường được kiểm soát cuối cùng đã được thiết kế để duy trì khả năng tồn tại của tế bào và theo dõi khối lượng tế bào trong nhiều ngày. Việc kiểm soát hệ thống môi trường được trang bị một giá đỡ mẫu độc đáo có chức năng điều chỉnh CO2, nhiệt độ và độ ẩm, đóng vai trò như một tủ ấm nuôi cấy tế bào nhỏ. Hình 5 cho thấy sơ đồ nguyên lý của thiết lập này.
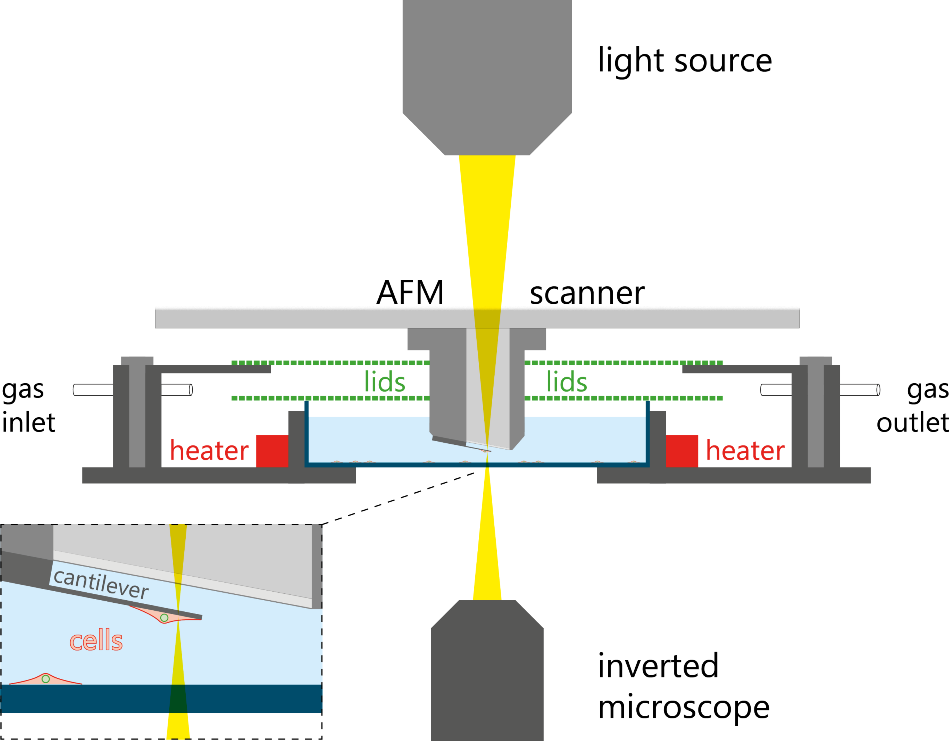
Hình 5. Sơ đồ thiết lập cân bằng pico. Nguồn hình ảnh: Nanosurf AG
Các nhà nghiên cứu đã chọn các tế bào HeLa làm tế bào chủ và gắn các tế bào này vào các Cantilever được phủ collagen I. Để nghiên cứu sự ảnh hưởng của nhiễm virus lên khối lượng tế bào, các nhà nghiên cứu đã cho phép một tế bào đơn HeLa được gắn với Cantilever duy nhất tiếp xúc với các tế bào BSC 40 bị nhiễm virus vaccinia (VACV) được nuôi sẵn trong đĩa của máy ủ tế bào.
Do đó, tế bào liên kết với Cantilever có thể bị nhiễm bệnh có chọn lọc. Các nhà nghiên cứu đã lây nhiễm vào các tế bào một loại virus vaccinia tái tổ hợp bao gồm protein lõi A4 được gắn thẻ eGFP. Điều này được thực hiện để theo dõi quá trình sản xuất các hạt virus mới bằng kính hiển vi huỳnh quang. Theo thời gian, cường độ huỳnh quang của các tế bào bị nhiễm bệnh tăng lên, điều này cho thấy các hạt virus mới đang hình thành trong tế bào.
Cả tế bào đối chứng và tế bào HeLa bị nhiễm bệnh đều cho thấy khối lượng của các tế bào liên kết thay đổi không liên tục vài phần trăm trong khoảng thời gian vài giây. Nhưng khối lượng tế bào bị nhiễm bệnh tiếp tục không đổi trong một thời gian dài hơn và không đi vào quá trình phân bào.
Các tế bào bào đối chứng không tiếp xúc với các tế bào bị nhiễm độc tăng dần về khối lượng và sau đó phân chia trên phần Cantilever, như trong Hình 6.
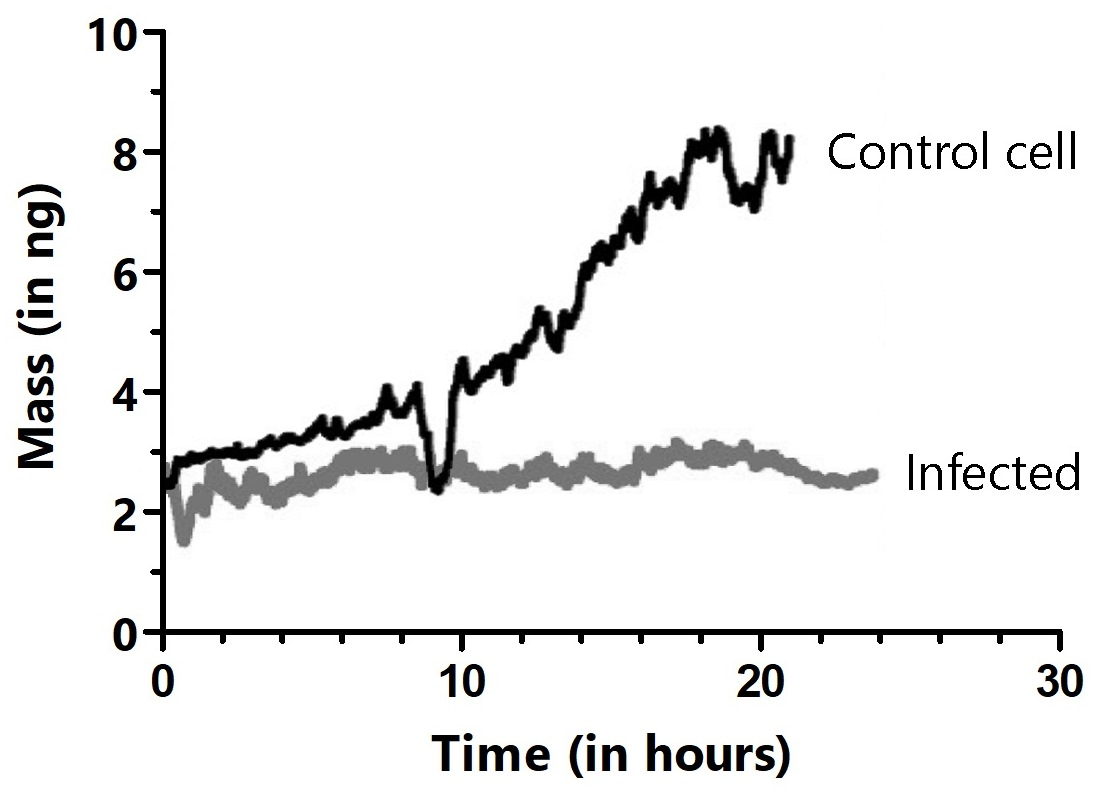
Hình 6. Nuôi cấy lâu dài và giám sát đối chứng hàng loạt (đường đen) và tế bào HeLa nhiễm virus (đường xám). Các tế bào bị nhiễm bệnh bằng cách đưa tế bào gắn vào Cantilever tiếp xúc với một tế bào bị nhiễm bệnh trong đĩa Petri. Các vết lõm trong đường đen cho thấy nơi xảy ra quá trình phân bào, trong đó các tế bào tròn lại và chỉ bám dính yếu vào phần nhọn của Cantilever. Nguồn hình ảnh: Nanosurf AG
AFM là một phương pháp tiên tiến có thể được sử dụng để nghiên cứu và khai thác các mẫu sinh học trong điều kiện sinh lý. Phương pháp này có thể được tích hợp với các phương pháp quang học phức tạp để giúp tương quan giữa đặc tính quang học của tế bào mẫu với các thí nghiệm AFM.
Bài viết này trình bày hai nghiên cứu về sự tương tác giữa vật chủ và virus ở cấp độ đơn bào. Trong trường hợp đầu tiên, phương pháp AFM được sử dụng làm công cụ thao tác sử dụng công nghệ FluidFM® technology. Trong trường hợp thứ hai, sự phát triển hàng loạt của các tế bào bị nhiễm virus được phân tích sau khi bị nhiễm bệnh.
Trước đây, nghiên cứu về virus đã giúp phát triển vắc xin và phương pháp điều trị. Các loại virus mới, như SARS-CoV-2 gần đây, đã gây ra đại dịch COVID-19, nhấn mạnh tầm quan trọng của việc nghiên cứu virus bền vững để phát triển phản ứng tốt hơn và nhanh hơn trước các đợt bùng phát sắp tới.
Thông tin này được lấy nguồn, xem xét và điều chỉnh từ các tài liệu do Nanosurf AG cung cấp.
Để biết thêm thông tin chi tiết, vui lòng ghé thăm website: https://www.nanosurf.com/en/